《材料科学与工艺》网络首发论文
Materials Science and Technology
ISSN 1005-0299,CN 23-1345/TB
DOI:10.11951/j.issn.1005-0299.20240019
原文链接:https://link.cnki.net/urlid/23.1345.tb.20240407.1946.002
作者:张 贵1, 杨宏韬2,6, 张万谦1,3, 刘爱华4, 张德元1, 高润霖5, 郑玉峰2
摘 要: 药物洗脱支架(Drug Eluting Stent, DES)的靶病变失败率(Target Lesion Failure, TLF)逐年增加,远期效果不佳。发展可吸收支架(Bioresorbable Scaffold, BRS)是解决上述问题的临床共识。在不添加任何有毒金属元素的前提下,Fe-N 合金材料凭借其优异的综合力学性能脱颖而出,由Fe-N 合金材料制成的铁基可吸收药物洗脱支架(Iron-Based Scaffold, IBS),不仅实现了超薄杆壁设计(壁厚薄至50μm),且可在术后3~6个月内保持与钴铬合金DES相当的径向支撑强度,并在术后2~3年内逐渐降解而被人体吸收,有望降低DES支架植入带来的远期风险。本文以近20年的基础和转化医学研究为基础,详细探讨了铁基BRS支架研发过程,包括纯铁氮化技术、超薄杆壁BRS支架设计、药物涂层设计、生物相容性、体内降解行为、临床试验进展以及未来挑战等,旨在为临床医学应用提供参考,并期望为本领域的后续研究带来启示和借鉴。
关键词:可降解金属;可吸收支架;铁基可吸收支架;支架设计;临床研究;研究进展。
随着社会经济的发展及人口老龄化的加速,心脑血管疾病发病率逐年上升, 其中冠心病(Coronary Artery Disease, CAD)已是目前世界范围内第一大死亡原因。经皮冠状动脉介入治疗术(Percutaneous Transluminal Coronary Intervention, PCI)已成为当今CAD 治疗的首选。1977 年德国Andreas Grüntzig 医生使用球囊导管完成世界第一例经皮冠状动脉血管成形术(PTCA, Percutaneous Coronary Angioplasty),被称为介入心脏病学的第1 次革命。1986 年,Puel 和Sigwart 完成了第一枚裸金属支架(Bare Metal Stent, BMS)植入,被称为介入心脏病学的第2 次革命。2002 年第一枚药物洗脱支架(Drug-eluting Stent, DES)问世,被称为介入心脏病学的第3 次革命。尽管当今普遍使用的最新代DES 治疗的第1 年内靶病变失败率(Target Lesion Failure, TLF)低至5.0%左右,但随后的时间里,TLF 每年以2%~3%的速度递增,由于每年接受PCI 的人群庞大,人们仍然担忧体内长期存在的金属植入物带来的晚期风险。从长期安全性考虑,生物可吸收支架(Bioresorbable Scaffold, BRS)是最好的解决方案,BRS 在植入的第1 年内能够提供与DES 相似的机械支撑和药物传递,短期治疗安全性和有效性可比拟DES,同时期望其在2~3 年内完全被人体吸收,避免植入物永久存在于体内,从而消除支架相关的晚期TLF,所以,BRS 被誉为介入心脏病学的第4 次革命。
考虑到血管重塑期间对血管壁的支撑强度要求,高分子聚合物、镁合金和锌合金材料的综合力学性能都很难通过改性达到主流DES 所使用的Co-Cr 合金水平,为了满足最低的支撑强度要求,上述材料制成的BRS 支架杆壁厚均较厚(大部分约150 μm),远大于当今主流DES 的60~90 μm。大量临床研究已证实,支架杆壁厚是靶血管血运重建(Target Vessel Revascularization, TVR)和支架内血栓(Stent Thrombosis, ST)的独立预测因素,较厚的支架杆壁也会占据一部分管腔面积,从而限制厚壁的BRS 在小血管中的应用。而铁和Co-Cr 合金均是立方晶系,具有高熔点,高弹性模量的特点,提高综合力学性能最为容易,通过材料冷加工、热处理、合金化或其他改性,甚至可以获得与Co-Cr 合金相媲美的优异综合力学性能。
电沉积或交叉轧制的纯铁虽然具有良好的生物相容性、更高的腐蚀速率和强度,但材料的塑性却大大降低,不适合用于生产使用过程中变形量大的血管支架。2010 年Hermawan 等报道了Fe-Mn 合金,该合金中加入大量Mn 元素获得奥氏体组织,可实现在提高腐蚀速率的同时提高核磁兼容性,同时力学性能与316L 相当,但大量Mn 元素的加入也会使得生物相容性显著降低。还有一些研究加入溶解度较小的元素,例如Ag、Pt、C 等,其掺杂在铁素体基体中能够析出电极电位更高的第二相颗粒,从而促进腐蚀和改善力学性能。在合金化中添加任何新的金属元素和影响生物相容性的元素都不是好的选择,因此,一些非金属元素成为纯铁合金化改性的首选。目前,可以添加的非金属元素有C、H、O、N、P、S、Si、F 和Se 等[22]。显然,H 和O 不适合纯铁材料合金化,而Si、F 和Se 不是人体中含有的常规元素,加入后不利于生物相容性。C、N、P 和S都是人体中的常规元素,适合用来提高纯铁的力学性能,且这几种元素均可以通过固态渗入的方法合金化,无需进行熔炼,也便于工艺优化。其中,C、P 和S 都是纯铁中已有的杂质元素。P 和S 与铁的合金化合物的熔点低而脆,凝固时易偏聚在晶界导致合金化后的铁合金脆性增加。C 与铁的合金就是常说的碳钢,随着C含量的增加,碳钢的强度也会增加,腐蚀速率会加快,但合金的塑性会降低,因此C元素也不是比较好的选择。通常钢铁中并没有N 元素,只有一类含N 不锈钢中用N 替代Ni 来改变共析相变温度,调节相结构,但N 在高温时会成为N 气泡溢出,会给熔炼带来额外问题。如果用渗入的方法,则N 具有特殊优势,因N 原子半径远小于Fe 原子,可以在较低温度渗入,因此,早在1913 年研究者们就发明了钢的渗氮处理工艺。在纯铁中渗入小于0.1wt.%的N 元素,并配合热处理工艺,即可得到综合力学性能(抗拉强度、塑性和Young,s 模量)与Co-Cr 合金相媲美的Fe-N 合金可吸收材料。
针对铁基BRS 的最早研究见于2001 年德国医生Peuster,在兔子腹主动脉植入Φ3.0 mm× 16mm 纯铁BRS(Nor-I),进行了为期18 个月的动物实验,验证了纯铁具有良好的生物相容性,但由于支架杆壁较厚,完全腐蚀的时间非常长。2006 年,他又报道了纯铁BRS 在猪的降主动脉植入的一年随访结果,其组织增生与对照组316L 不锈钢BMS 相似,但一年内几乎没有降解。2008年美国医生Waksman 等报道了纯铁BRS 在猪冠状动脉中的1 个月结果,内皮化快于对照组Co-Cr合金BMS,新生内膜增生也小于对照组,但降解速度太慢是必须解决的问题。此外,2009 年有文献报道,在体外细胞培养过程中显示铁有细胞毒性,至此,铁基BRS 研究基本处于停滞状态。
铁基BRS 亟待解决以下几点问题:1)铁在体内腐蚀速率慢,固体腐蚀产物极难在植入位置被组织完全吸收清除;2)铁材料的固有磁性可能会影响MRI 兼容性;3)有学者认为铁腐蚀产生的铁离子会参与芬顿(Fenton)反应,产生以羟基自由基(•HO)为代表的活性氧(Reactive Oxygen Species, ROS),可能促进动脉粥样硬化和氧化损伤。2013 年,作者团队报道了Fe-N 合金BRS 在猪冠脉和髂动脉的植入实验,研究表明该Fe-N 合金具有很好的生物相容性,Fe-N 合金BRS 的降解速度相对于纯铁BRS 大大加快,而此时Fe-N 合金BRS 支架杆壁厚已经从纯铁的120 μm 降至70 μm,径向支撑强度高达170 kPa 。2015~2019 年间作者团队陆续又报道了Fe-N 合金药物洗脱BRS,其涂层体系由内层的Zn 缓蚀层和外层携西罗莫司的聚-DL-乳酸(Poly(D,L-Lactic Acid), PDLLA)构成,Fe-N 合金基体的厚度仅为50 μm 左右,径向支撑强度120 kPa,其支撑强度与当今主流Co-Cr 金属DES 相当,而铁用量仅有纯铁BRS 的17%。至此,已往铁基BRS 存在的问题在一定程度上得到了进展和澄清。这种Fe-N 合金BRS 的设计总结起来可分为3 个要点:1)通过离子渗N 合金化技术在纯铁中渗入约0.05wt.%的N 元素,提高纯铁材料的综合力学性能,从而降低支架杆壁厚,减少铁用量,缩短全降解周期。同时,渗入的Fe4N 和Fe 之间形成电偶腐蚀,可提高Fe-N 合金腐蚀速率,缩短腐蚀时间;2)在Fe-N 基体上镀一层600 nm 左右的锌缓蚀层,以保护Fe-N 基体在植入的前3~6个月不腐蚀,维持有效支撑时间,免除前3~6 个月降解所需的铁量,从而进步减小Fe-N 基体壁厚;3)使用大分子的PDLLA 作为药物载体材料,在用其搭载抗血管平滑肌细胞增殖的西罗莫司药物的同时,降解时产生酸性的中间产物(可溶性低聚物和乳酸),人为的在Fe-N 基体周围持续创造一个微酸性环境,以加快Fe-N 基体的腐蚀,缩短腐蚀时间。本文结合作者团队近20 年的相关研究,从Fe-N 合金BRS 原材料纯铁氮化技术、超薄杆壁BRS 设计、药物涂层设计、生物相容性、体内降解行为、临床实验进展、未来挑战等方面详细评述了铁基BRS 的研发历程,以期为铁基BRS 的临床医学应用提供参考,并为该领域的后续研究带来启示和借鉴。
1. 纯铁渗氮处理及Fe-N 合金药物洗脱BRS 设计
1.1. 纯铁渗氮处理
纯铁质地较软,抗拉强度210 MPa,Young,s模量150 GPa,而早期BMS 和一代DES 所使用的316L 不锈钢抗拉强度为670 MPa,Young,s 模量193 GPa,二代DES 的Co-Cr 合金抗拉强度>1000MPa,Young,s 模量为243 GPa,纯铁体内降解速度也非常缓慢,因此纯铁不适合直接用于制造BRS。解决纯铁BRS 腐蚀慢的途径有:1)提高纯铁的综合力学性能,降低支架杆壁厚,减少铁用量,缩短腐蚀和吸收时间;2)加快铁在体内的腐蚀速率,缩短腐蚀和吸收时间,此外,降低支架杆壁厚也能大幅提升支架临床使用的有效性和安全性。
纯铁渗氮处理配合不同的热处理及塑性变形工艺,在不添加有毒元素和其他金属元素的情况下,即可获得媲美Co-Cr 合金相同的综合力学性能,需要强调的是,渗氮本是材料表面处理技术,由于支架杆很薄,便可作为整体合金化技术来使用,因此,N 元素渗透整个支架杆截面。根据Fe-N 相图,592 ℃时N 元素在α 铁素体中的最大固溶度是0.1wt.%,随着温度降低到室温,N 元素会以Fe4N 第二相析出,弥散析出在α 铁素体基体上。如N 含量高于0.1wt.%,则可能会析出粗大Fe4N 第二相,严重降低Fe-N 合金材料强度和塑性。为了获得最佳的综合力学性能,N 含量应控制在0.1wt.%以下,且高度弥散的Fe-N 第二相析出在过饱和含N 铁素体基体中,获得固溶强化和弥散强化的双重强化效果。研究发现,在纯铁中渗入约0.05wt.%的N 后, 经850~950 ℃高温退火,多道拉拔(550~650 ℃热处理交替进行),Fe-N合金管的屈服强度(830 MPa±18 MPa)、抗拉强度(1000MPa±100 MPa),均显著高于渗氮前完全退火态的纯铁管的屈服强度(121 MPa±6 MPa)和抗拉强度(273 MPa±10 MPa),且保持良好的塑性,该Fe-N 合金综合力学性能与Co-Cr 合金相当,具体参见图1 所示。
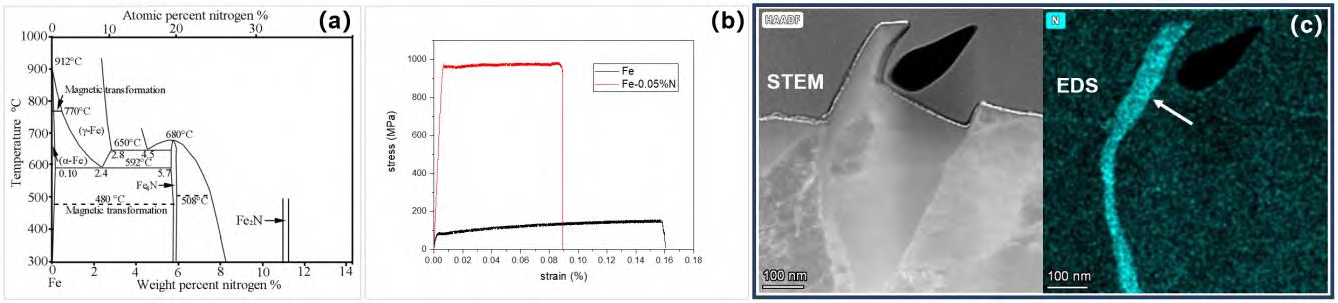
图 1 纯铁渗N 处理提升综合力学性能原理和实验图: (a) Fe-N 合金相图;(b) Fe-0.05%N 与退火态纯铁管拉伸曲线对比图;(c) TEM 和EDS 下Fe-N 中条状分布的Fe4N 初晶照片
1.2. Fe-N 合金药物洗脱BRS 设计
1.2.1. 支架基体结构设计
Fe-N 合金基体采用99.5wt.%的纯铁管,在500 ℃、50 Pa 压力下进行2 h 的真空等离子体渗氮处理,渗入约0.05wt.%的N 元素,随后经激光切割成相应规格的支架,并采用化学抛光制成所需壁厚的Fe-N 合金基体,壁厚70 μm 径向强度170kPa,50 μm 径向强度120 kPa。渗氮处理后Fe-N 的第二相颗粒在纯铁中均匀弥散分布,使得Fe-N 合金具备高强度和高弹性模量,Fe-N 合金BRS 可承受剧烈的塑性变形,如图 2 所示。Fe-N 合金BRS壁厚和支架综合力学性能优于目前最先进的Co-Cr合金支架(Xience PrimeTM, 壁厚81 μm)。

图 2 Φ3.0 mm× 18 mm Fe-N 合金BRS 的边支通过性示意图: (a)带有边支的模拟血管 ;(b) 将Fe-N 合金BRS 与模拟血管上的开口对齐; (c)Φ2.25 mm 的球囊对支架网孔进行扩张; (d)测量Fe-N 合金BRS上扩张的网孔内径
在满足支架力学性能要求的同时,无论是DES 还是BRS 都期望支架杆壁更薄,图 3 比较了不同代次的DES 和BRS 支架杆截面尺寸,DES 和BRS 的发展趋势都是趋向于支架杆越来越薄,截面积越来越小。但DES 所使用的Co-Cr 合金DES,除了满足血管所需的支撑强度要求,还需要考虑支架在血管壁里至少10 年保持不疲劳断裂,因此不能设计得太薄。为此,主流的DES 壁厚大多在80 μm 左右,Biotronik 的小直径OrsiroDES 的60 μm 已经是极限。而BRS 预期只需维持3~6 个月左右的有效支撑,血管病变修复完成后即可完全降解吸收,无需考虑长期疲劳断裂问题,可尽可能减小支架杆壁厚来提高BRS 的支架性能。由于Fe-N 合金同时具备高强度和高塑性,因此支架杆壁降至50 μm,初始径向支撑强度仍与目前主流的Co-Cr 合金DES 基本一致。
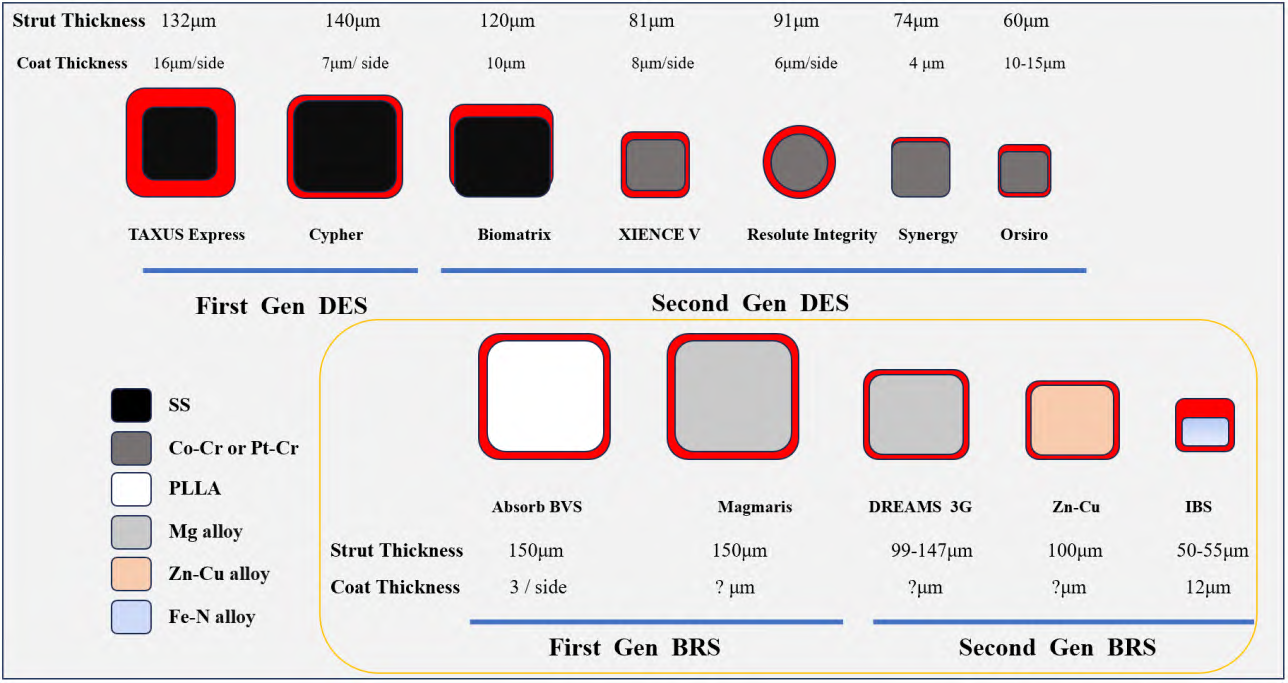
图 3 DES 和BRS 支架杆截面尺寸演变
1.2.2. 支架涂层设计
理想的BRS 支架应满足植入时有足够的支撑强度消除靶病变血管的急性回缩,同时提供抑制血管平滑肌细胞增殖的药物,并可在3~6 个月后降解失去大部分的机械支撑力,2~3 年完全降解和吸收。PLA 是DES 广泛应用的药物涂层载体材料之一,其体内降解时产生的中间产物(可溶性低聚物和乳酸)具有酸性,可加速Fe-N 合金BRS 的腐蚀,缩短降解周期。Yusop 等[46]的研究也显示,聚乳酸-羟基乙酸共聚物(Poly (Lactic-Co-Glycolic Acid),PLGA)降解产生酸性基团可以加速铁的腐蚀,即使在PBS(磷酸盐缓冲盐水)的缓冲系统中,也可能导致pH 从7.5 降至5~6。Lin 等在70 μm壁厚的Fe-N 合金基体上喷涂5 μm 携带西罗莫司的PDLLA 涂层,虽然在植入3 个月后仍能够维持足够的径向支撑强度(119 kPa),但在植入13 个月后,质量损失仅为56%±8.2%,腐蚀周期过长。Qi 等也在70 μm 壁厚的Fe-N 合金BRS 表面喷涂128 μg 大分子的PLA (Mw=200 kDa)和32 μg 低分子的PLA(Mw=50 kDa)混合涂层,植入3~6 个月即完全腐蚀降解,支架完全丧失支撑强度,达到12 个月时腐蚀产物大部分吸收,由于腐蚀速率太快,不能满足血管修复所需的支撑时间。Fe-N合金药物洗脱BRS 的腐蚀速率并非越快越好,需根据组织对降解产物的耐受性和血管重塑所需的时间来设计,选择合适厚度和分子量的PDLLA 载药涂层,从而得到理想的降解时间。Lin 等报道了在Fe-N 合金基体表面引入Zn 缓蚀层的技术方案,利用Zn 缓蚀层作为牺牲阳极推迟Fe-N 合金BRS 腐蚀启动时间,后期通过大分子PDLLA 加速Fe-N 合金腐蚀。通过动物实验证明,约600 nm 厚的Zn 缓蚀层可满足Fe-N 合金药物洗脱BRS 植入前3 个月不腐蚀,维持Fe-N 合金基体初始支撑强度,3~6 个月后,不提供支撑强度的Zn 缓蚀层完全腐蚀,Fe-N 合金基体在PDLLA 酸性降解产物的加持下快速腐蚀。动物实验结果显示,在50 μmFe-N 合金基体由内向外依次涂上600 nm 的Zn 缓蚀层和7~13 μm 携带西罗莫司的PDLLA 涂层,植入兔子腹主动脉,3 个月后Fe-N 合金基体失重仅为2.0%±1.8%,径向支撑强度维持在初始的120kPa 左右不变,植入6 个月后失重45.9%±9%,植入13 个月后失重95%±4%(几乎完全腐蚀),其降解速度符合BRS 降解需求。由于Zn 缓蚀层的引入,Fe-N 合金BRS 基体在植入前3 个月基本不腐蚀,维持了血管修复所需的有效支撑时间,减少了前3个月铁腐蚀量,进一步降低了Fe-N 合金药物洗脱BRS 的壁厚,从而提高了BRS 的支架性能。Fe-N 合金药物洗脱BRS(商品名IBS)PDLLA 涂层中所携带的西罗莫司(Sirolimus)剂量约为8μg/mm,动物实验显示,达到抑制新生内膜增殖的效果, 降低了植入后支架内再狭窄(In-stentRestenosis, ISR)的发生。最终IBS 支架杆壁总厚仅为70 μm (PDLLA 载药涂层厚+Fe-N 合金基体壁厚),支架径向支撑力120 kPa,压握后支架系统的截面直径(Profile)约1.0 mm。IBS 的系统结构设计如图4 所示,支架性能足以对标当今主流的DES(Xience Prime™)。此外,IBS 支架的运输和储存温度在30 ℃以下,与普通DES 相同,无需冷链运输和冰箱储存,极大地方便了运输和储存。
1.2.3. 支架显影点设计
理论上Fe-N 合金在X 光下显影性与Co-Cr 合金材质相似,但当Fe-N 合金基体壁厚降到50 μm以下时,X 光显影性变得不清晰,故需在支架两端安装上黄金显影点来增强Fe-N 合金药物洗脱BRS的显影性。由于Fe-N 合金药物洗脱BRS 支架杆壁比较薄,显影点的安装方式与厚壁的BRS 有所不同。若仅设置一个大表面积的显影点,一方面,显影点铆定力不够且容易变形,增加脱落的风险;另一方面,表面积较大的单个显影点会增加支架整体的刚性,降低支架的柔顺性,并增加支架在球囊系统上压握后的截面直径(Profile),影响植入时的输送性能。因此,Fe-N 合金药物洗脱BRS是由4 个黄金点组成的梅花状的显影区域,在支架两端各安装一组,既满足显影效果,同时也可降低脱落风险和减少显影点对支架性能的影响,如图4 所示。
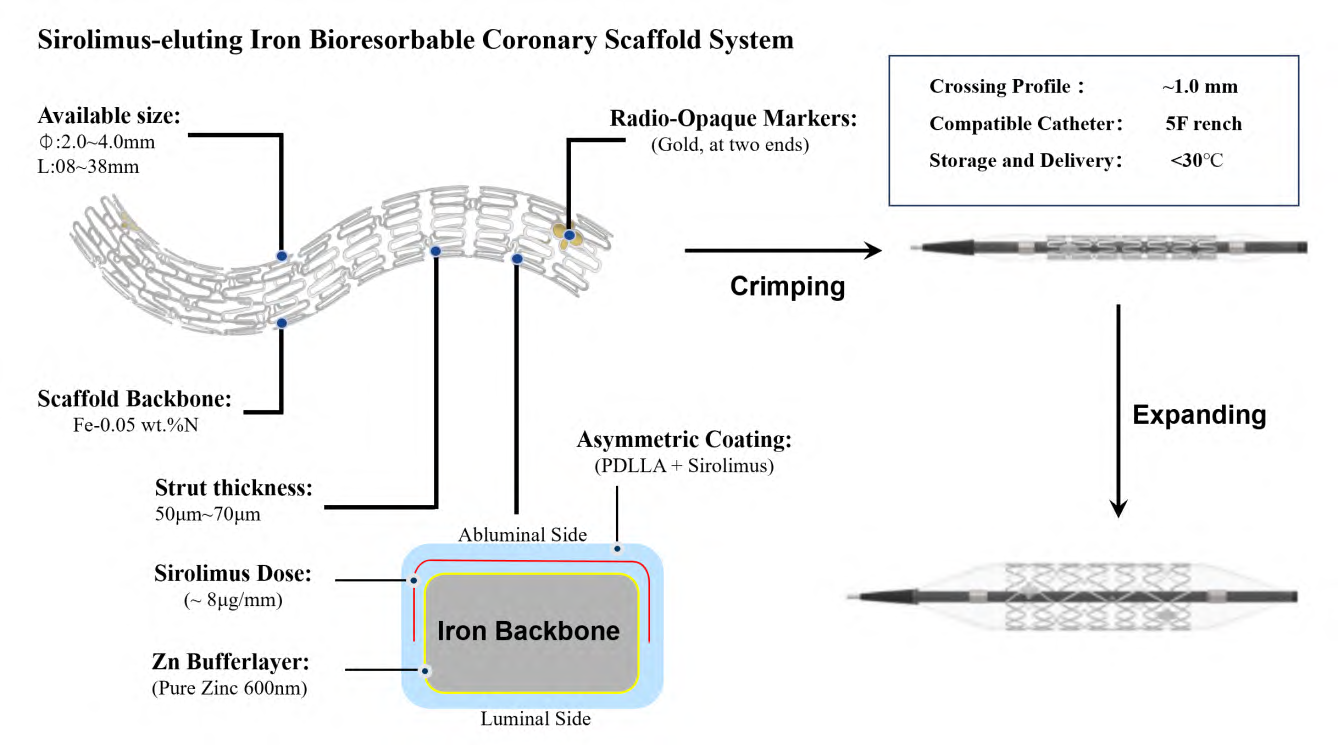
图 4 Fe-N 合金药物洗脱BRS(IBS)的系统结构设计
2. Fe-N 合金BRS 降解行为和生物学相容性
2.1. 生理环境下降解行为
通过热力学理论分析,无PDLLA 涂层的Fe-N 合金在体内环境条下(铁离子浓度c(Fe)=3×10-5mol/L, 磷浓度c(P)=2×10-3 mol/L, 氧分压p(O2)=13.3 kPa;pH=7.4;T=37 ℃)最稳定相是Fe2O3。缺氧情况下,如腐蚀过快氧补给不足时,最稳定相是Fe3O4。但在实际情况下,由于体内复杂的动力学原因,有些中间相会长期存在,如Fe3(PO4)2、FeOOH 等。通过对动物体内植入Fe-N合金BRS 腐蚀产物进行化学表征,在动物体内的典型腐蚀产物分别是磁性Fe3O4、非磁性Fe(OH)3和/或其脱水产物(FeOOH 和Fe2O3) 和/或Fe3(PO4)2,还有痕量Ca3(PO4)2 在腐蚀产物外围。在猪冠状动脉模型中,Fe-N 合金BRS 在4~5 y 内完全腐蚀,5~6 y 内大部分被生物吸收。如果引入PDLLA 载药涂层,载药涂层降解生成的酸性中间产物,将降低支架杆周围的pH值,大大加快Fe-N 合金基体的腐蚀,而降解产生的乳酸单体也可以螯合铁离子,加速铁离子离开支架,加快铁腐蚀产物吸收,腐蚀原理如图5 所示。
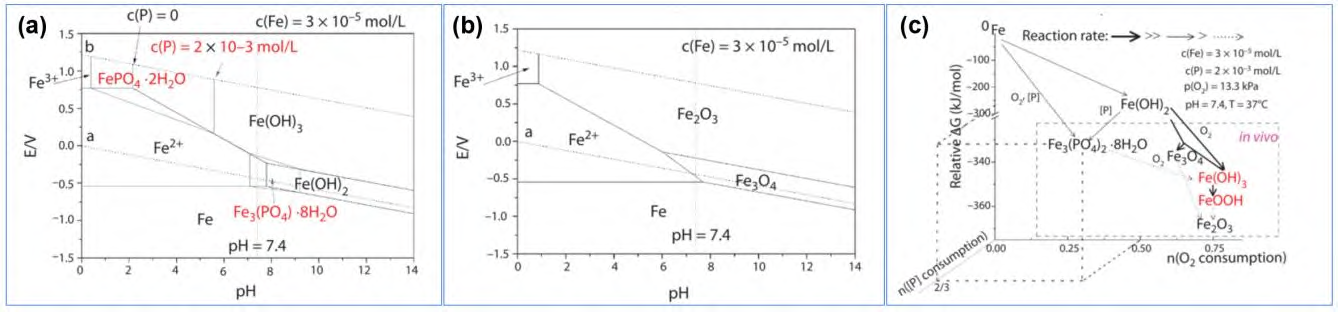
图 5 生理条件下铁腐蚀布拜图(a, b)及基于体内O2 和P 消耗量的可能的热力学反应途径(c)
50 μm 壁厚的Fe-N 合金基体外壁喷涂12 μm左右的PDLLA 涂层后,可以使Fe-N 合金基体在短短3 个月时间内完全腐蚀,在植入兔子腹主动脉1 个月后,支架杆周围被一薄层腐蚀产物(铁的氧化物或氢氧化物)包围。随着植入时间延长,围绕支架杆周围的腐蚀产物不断增多,且逐渐分散到杆周围的组织中,被缓慢吸收。植入后9 个月,除可观察到铁的氧化物或氢氧化物外,可能还有Fe3(PO4)2形成存在,同时有Fe、O 和P;并且在植入后1 年后可观察到原始支杆位置已经完全变为铁的腐蚀产物,且中间已被新生内膜组织填满。长期动物实验研究结果显示,吞噬细胞吞噬的固体降解产物,可能在吞噬细胞内低pH 值和酶的作用下溶解再次放出Fe3+,并与血液中铁蛋白结合形成铁蛋白微粒,若干铁蛋白微粒聚集成光镜下可见的含铁血黄素,含铁血黄素储存的铁最终被动员进入人体铁循环而被利用,Fe-N 合金BRS腐蚀产物的吸收机制如图6(a)所示,这与衰老的红细胞释放的铁或内出血中红细胞铁的回收机制相同[54-55]。Fe-N 合金被吸收后,支架杆原位组织中无Ca/P 沉积,组织恢复正常,见图6(b)所示。
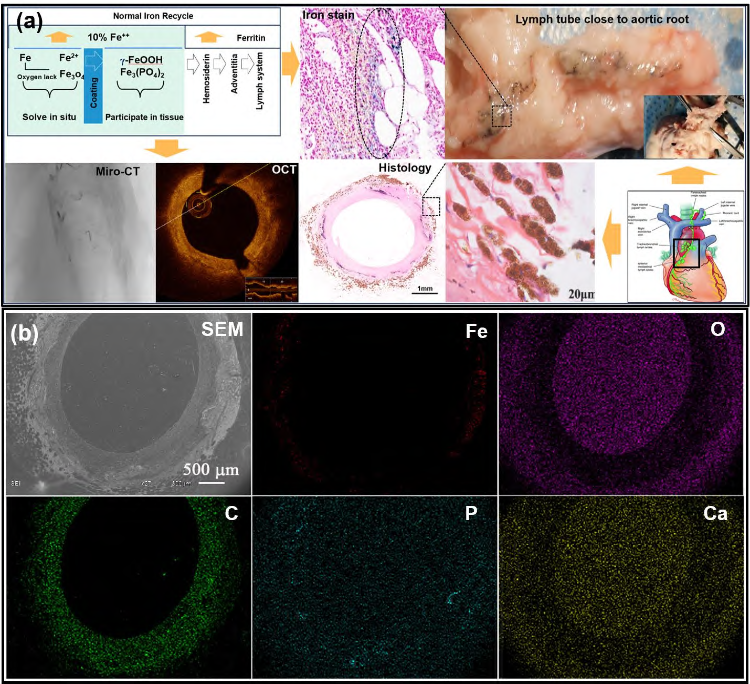
图 6 Fe-N 合金BRS 降解产物吸收过程(a)及(b)组织EDS 面扫描中Fe、P、 Ca 元素分布
所有的BRS在体内都很难均匀降解,均匀降解并不是临床需求,BRS对降解的要求是:1)BRS必须满足足够的支撑时间,即在病变血管完全重塑修复完成前,支架必须有足够的支撑强度防止病变血管管腔回缩,防止BRS过早降解导致血管病变处再狭窄,通常认为血管重塑时间为4~6个月;2)BRS未被血管新生内膜完全覆盖前,不可因腐蚀/降解导致表面物理和化学状态变化引起支架内血栓(Stent Thrombosis, ST),不可因腐蚀/降解导致支架杆断裂引起ST和ISR,不能产生栓塞下游血管的微粒脱落。对于血管重塑完成且支架被新生内膜完全覆盖后的情况,降解只要不引起ISR、ST等导致TVR即可。
2.2. 生物相容性
Fe-N 合金作为可吸收金属材料在人体内植入尚无先例,需基于ISO 10993.1 标准进行生物学评价,确保所有生物学风险都能接受。生物相容性根据组成器械的材料和浸出物作用于患者的范围,可分全身系统的毒性反应和局部反应,全身系统的毒性反应包括急性毒性、慢性毒性、致癌性等,局部反应包括组织刺激、致敏反应和血液相容性等。生物相容性评价通常可通过一系列体外或动物体内生物学实验来获取材料或器械的生物测试数据,再推理至人体使用时的安全性的方法。体外生物学实验包括细胞毒性实验、小鼠淋巴瘤基因突变、血液相容实验等;体内实验包括急性全身毒性、慢性毒性、致敏性、局部组织反应、热原等。
2.2.1. 铁的生理作用和Fe-N 合金BRS 全身毒性
铁是一种人类每天接触的金属元素,是人体的必需营养元素,其参与生命体各种代谢过程,包括氧转运、脱氧核糖核酸(DNA)合成和电子转运等。在许多重要的生物途径中,铁作为辅助因子对正常细胞的功能及调控起重要作用。铁也是人体血红蛋白、肌红蛋白、细胞呼吸酶的重要组成部分,正常成年男性每公斤体重含铁量为35~45 mg,绝经前的女性由于经期反复失血,铁储量会稍低。人体对铁的吸收、转运、利用等过程均有严格的调控,来避免铁中毒或铁缺乏的出现。但人类没有正常的铁排泄机制,铁的吸收量和铁的流失量通常是相等的,每天大约1~2mg的铁通过出汗、表皮脱落、膀胱和肠道粘膜细胞脱落以及出血的方式从体内流失。有研究认为,铁的平衡可通过膳食调节、储存调节和红细胞生成调节3种方式来实现。通常,铁过载是指体内总铁含量增加超过5 g时的病理状态,正常情况下,转铁蛋白结合Fe3+的饱和度仅为三分之一,当铁过载时转铁蛋白对Fe3+的结合才会处于饱和状态,多余的铁离子则会被血清蛋白给合,其结合力高达12 mg/L,这是因为人体内具有较高的调节能力,阻止血液中有毒性的游离铁离子存在。红细胞生成正常时的铁过载,血浆内的铁含量超过转铁蛋白结合能力,铁便会被储存在肝脏、心脏和内分泌组织的实质细胞内;另一种是红细胞代谢异常加速导致铁的过载,这种情况下铁会首先累积于网状内皮巨噬细胞内,之后溢出至实质细胞。以上两种铁过载均可导致实质组织损伤和器官衰竭,造成全身系统的毒性。值得注意的是,从Fe-N合金BRS总质量上分析,支架的植入不太可能导致铁中毒。一个常用规格的Fe-N合金BRS总铁质量不超过8 mg,是人体1周所需的铁总量,且Fe-N合金BRS植入后2~3年才完全吸收,因此,支架每天降解并释放进入血液的铁离子可以忽略不计。即使1次植入10个8 mg的Fe-N合金BRS,一天内完全腐蚀成铁离子不超过80 mg,不会导致铁过载引起全身系统性毒性风险。Shi等以人体暴露剂量的50倍以上Fe-N合金BRS在大鼠腹主动脉内植入,模拟人体血管植入环境,植入90d不会引起全身毒性,表明所测试的Fe-N合金BRS在未来的临床研究中是可行的。Shi等也采用同样植入大鼠腹主动脉的方法,评估Fe-N合金BRS降解产物的慢性毒性和致癌性,研究结果显示,Fe-N合金BRS不会引起全身毒性,在随访的2年中,Fe-N合金BRS完全吸收,且无慢性毒性和致癌性。
2.2.2. 铁及铁基合金的细胞毒性
细胞毒性研究大多数还是基于普通惰性生物材料的经典体外细胞毒性实验方法进行的,分别使用直接接触或浸提液间接进行细胞毒性测试,以往的许多研究报道了铁对内皮细胞(ECs)、平滑肌细胞(SMCs)和小鼠成纤维细胞(L929)等的体外细胞毒性,结果并不一致。Moravej等使用原代培养的大鼠平滑肌细胞(SMCs)暴露于电铸纯铁,细胞代谢活性未见明显下降,但细胞增殖活性降低,这可能有利于铁基BRS抑制新生内膜平滑肌细胞增殖,减少ISR;Nie等使用纯铁与不同细胞直接和间接接触培养测试,发现铁能够更好地促进L929 细胞和人脐静脉内皮细胞(ECV304)活性,同时能有效地抑制血管平滑肌细胞(VSMCs)的活性;Zhang等的研究则认为,除25%纯铁稀释浸提液作用24 h外,其余浓度的纯铁浸提液均对细胞有明显的毒性作用,且随着铁离子浓度的增加和作用时间的延长,毒性作用逐渐增强。Liu等认为铁离子对细胞毒性的影响存在一个铁离子浓度阈值,研究人员分别使用铁与Mn、Co、Al、W、Sn、B、C和S元素形成的二元铁基合金浸提液进行细胞毒性实验,研究发现这些二元铁基合金浸提液与纯铁相比均降低了L929细胞的存活率,所有实验中合金元素均未显著降低小鼠VSMCs的存活率,且除Mn外,所有元素均提高了ECV304细胞的存活率。
铁基合金BRS 腐蚀过程中释放的Fe2+离子是不稳定的,Fe2+会被氧化成Fe3+形成固定腐蚀产物。因此,有研究者直接使用不同价态的铁离子进行细胞毒性测试,发现亚铁离子浓度低于10 μg/mL时对ECV304 细胞代谢活性可能产生有利影响,而亚铁离子浓度高于50 μg/mL 时细胞代谢活性显著降低。当使用30 μg/mL 可溶性Fe(II)铁离子加入细胞培养基时,人原血管SMCs 细胞的生长被抑制, 基因表达谱显示细胞增殖所需基因的mRNA 量减少,过量Fe(II)对SMCs 细胞增殖的抑制表明,铁基BRS 降解产物可能对控制新生内膜增殖是有益的。Fagali 等研究了铁释放的可溶性和不溶性腐蚀产物(铁微粒或大块铁)对邻近成纤维细胞的生物影响,他们的研究认为不溶性铁腐蚀产物细胞毒性和细胞内活性氧(ROS)有关,而可溶性腐蚀产物并不影响细胞活力。Scarcello 等在体外细胞实验中记录了羟基自由基(•HO)在铁腐蚀过程中的产生,以及它们对体外培养的人ECs 和SMCs 的有害影响,但只要加入少量过氧化氢酶就可以消除这种有害影响,而过氧化氢酶正是人体中ROS 的平衡机制之一。Lin 等则根据铁基材料在体内腐蚀时的风险,分别设计细胞毒性方法评估可溶性腐蚀产物、不可溶性固体腐蚀产物和可溶性产物在空气中氧化成不可溶性固体微粒的细胞毒性,结果显示铁基浸提液中可溶性Fe2+的占比较大,其浓度是氧化后Fe3+浓度的一个数量级以上。铁基浸提液细胞毒性不是因为铁离子浓度超过细胞毒性浓度,而是可溶性Fe2+离子在细胞培养时氧化成溶度积更低的Fe3+离子,析出固体微粒导致的,大块的固体腐蚀产物和铁基材料均无细胞毒性。也有研究在铁基材料浸提液中加入胎牛血清或小牛血清,可清除可溶性浸提液细胞毒性,由此推测,铁基材料浸提液细胞毒性是因为游离铁离子导致的。细胞培养受多种因素影响,且体外环境下的实验也缺少了完整的模拟体内系统环境的步骤,因此可能产生上述研究中的相互矛盾的实验结果。由于铁基材料腐蚀与环境直接相关,只通过简单的体外细胞相容性评估是无法模拟真实的人体内的复杂环境的,实验结果与实际存在偏差。因此,还需使用哺乳动物体内实验对铁基合金BRS 进行长期测试来确定铁基材料的毒性。
2.2.3. 铁参与的过氧化损伤
在细胞水平上,铁是细胞生长、修复甚至某些形式的细胞死亡所必需的,即所谓的铁死亡,体内铁平衡被破坏时,多余的Fe2+在细胞中积累形成不稳定铁池,铁池中游离的Fe2+与过氧化氢发生芬顿反应,生成以•HO为代表的ROS。一定浓度的ROS是人体必需的,也是生物体利用氧时不可避免的副产品。但过多的ROS可能氧化脂质和诱导DNA损伤,形成动脉粥样硬化和引起细胞死亡,但目前很多人质疑体内芬顿反应的存在和意义,因为体内Fe2+和H2O2浓度都极低。ROS对DNA的损伤最为强烈,在化学致突变性/遗传毒性中的可能作用已有许多报道,可导致肿瘤或癌症发生。致癌性检测可分为长期致癌检测和短期快速筛查法,快速筛选方法主要是对体外培养的细菌或细胞进行,如Ames实验和哺乳动物细胞体外转化实验。体外快速筛查实验受多种因素影响,其可靠性相较使用完整的哺乳动物进行的长期致癌测试更低。长期致癌测试多使用小鼠或大鼠等啮齿动物进行,因为它们的质量小、寿命长、自发肿瘤率低。将Fe-N合金药物洗脱BRS(IBS)植入大鼠腹主动脉,模拟植入人体时与血液接触环境评估降解产物的致癌性和慢性毒性,2年随访结果显示并无致癌性和慢性毒性。虽然理论上铁可能会参与芬顿反应生成ROS,但只要不破坏体内ROS平衡系统就不会导致ROS浓度的升高,也不会引起体内的氧化应激。当铁基BRS植入体内后,铁离子平衡和ROS的平衡并未被破坏,因此体内实验随访结果并未发现致癌性和慢性毒性;值得说明的是,铁也是所有生命体不可缺少的过渡金属元素,在其氧化还原活性的基础上发挥了各种重要的生理作用,铁平衡的破坏会引发氧化损伤。因此,细胞进化出了一套极其完善复杂的铁吸收机制,以保护细胞在吸收过程中免受失控的氧化损伤。铁基BRS在体内腐蚀释放出的铁离子也会第一时间与组织液或血液中的转铁蛋白或铁蛋白结合,进入正常机体生理活动所需的铁循环,而与蛋白结合的铁不产生游离态的Fe2+或Fe3+铁离子,无法参与芬顿(Fenton)反应生成•HO为代表的ROS,有氧生物体内存在氧化和抗氧化平衡机制,可消除铁基BRS周围形成的多余ROS,维持合理的ROS浓度,避免氧化损伤。Fe-N合金BRS植入猪冠脉随访7年,未发现支架内动物粥样硬化斑块,Fe-N合金药物洗脱BRS(IBS)植入人体3年随访实验中,也未观察到支架内新生动脉粥样硬化,这些都印证了支架腐蚀所释放的铁离子并不太可能产生脂质氧化。
2.2.4. Fe-N 合金药物洗脱BRS 内皮化和血液相容
ST和晚期支架内血栓(Late Stent Thrombosis,LST)是PCI的一种不常见但严重的并发症,发生率在2.4%左右,死亡率在5%~45%,也有报道称死亡率超过50%。支架内皮化速度是支架安全性的重要指标之一,内皮功能恢复后ST风险降低,支架内皮化速度不仅与支架材料、药物及涂层相关,也与支架杆壁厚薄有关,支架杆越薄内皮化速度越快,对血液扰动越小,ST风险越低。Fe-N合金药物洗脱BRS(IBS)在兔子髂动脉模型中,内皮化显著快于DES(Xience 支架),爬覆的内皮细胞中,已经恢复正常功能的内皮细胞的覆盖率和Xience支架相当,如图 7 所示。Fe-N合金药物洗脱BRS在不贴壁的情况下,支架内皮化速度慢,腐蚀释放的铁离子会直接进入血液,支架杆上不会形成固体腐蚀产物,不用担心固体产物脱落栓塞下游血管风险。随着植入时间的延长,支架杆腐蚀导致表面光滑度降低,增加了支架杆对血液中蛋白、血细胞等成分的粘附能力,最终促进不贴壁支架杆完全内皮化。Shi等[85]在不贴壁的兔子髂动脉分叉模型中植入Fe-N合金BRS,3个月随访时,唯有分叉口悬空部位的支架杆表面无固体腐蚀产物,也无内皮覆盖,9个月随访时,显示分叉口悬空的支架杆已完全内皮化,无血栓形成。
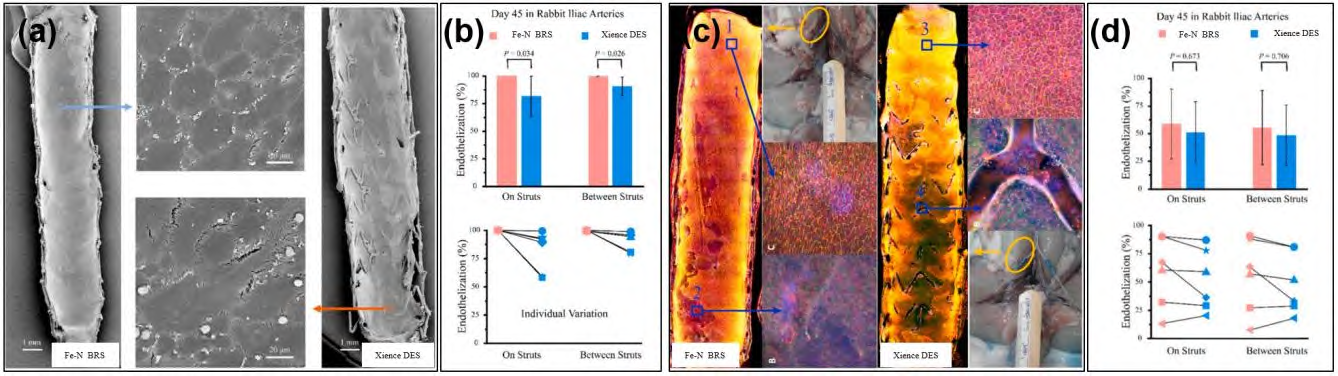
图 7 Fe-N 合金BRS 和 Xience 永久DES 植入45 d 时新生内膜覆盖及内皮细胞分析:( a, b)扫描电镜图及支架新生内膜覆盖率;聚光共聚焦显微镜图及内皮细胞覆盖率(c, d)
2.2.5. 铁基BRS 组织反应和体内降解吸收行为
2001年和2003年Peuster最早报道了纯铁BRS在兔子腹主动脉和猪的降主动脉模型中的研究结果,他认为铁是一种合适的可降解支架材料,特别是没有血栓、没有明显炎症反应,腐蚀产物与蛋白结合形成含铁血黄素,可转移至血管外膜通过淋巴系统排除,也没有局部或全身毒性,但纯铁BRS腐蚀降解也相对非常缓慢。2008年美国医生Waksman报道了纯铁BRS在猪冠脉模型中植入1个月随访结果,也显示纯铁BRS有很好的生物相容性,无明显炎性反应,内皮化速度也快于对照的Co-Cr合金BMS,狭窄率也小于对照组。该研究认为纯铁适合作为BRS材料,但腐蚀降解速度太慢也是必须解决的问题。Wu等的研究发现,通过离子渗氮处理可提高纯铁的力学性能,达到降低支架杆壁厚并提高腐蚀速率目的,70 μm的Fe-N合金非载药BRS植入猪冠脉1个月随访结果也显示,新生内增生和炎性反应与对照组的钴铬合金BMS相似,但支架未见明显腐蚀降解。Lin等报道了Fe-N合金非载药BRS在兔子腹主动脉植入36个月的结果,此时支架腐蚀失重76%,而相同壁厚的纯铁BRS失重仅44%,证明渗氮处理可明显加速纯铁的腐蚀。在猪冠脉植入4.5 y时,Fe-N合金BRS支架出现了腐蚀不均的现象,部分支架杆完全腐蚀和吸收,腐蚀产物被吞噬细胞吞噬转移至血管外膜,形成含铁血黄素铁,组织无炎性反应,没有全身毒性和冠状动脉瘤,生物相容性好,Fe-N合金腐蚀速率虽然比纯铁快一倍,但作为BRS材料,腐蚀降解速率还是太慢。Fe-N合金非载药BRS植入猪冠7年后,支架完全降解和吸收,长期组织病理分析结果显示血管解剖结构与无植入支架的健康血管无明显区别,铁基BRS腐蚀产物通过淋巴系统实现铁循环的安全吸收。Fe-N合金药物洗脱BRS由于聚乳酸涂层的引入,大大加速了体内的降解速率,值得注意的是,Fe-N合金药物洗脱BRS植入不同的动物模型和人体中,甚至是不同植入部位,其腐蚀降解速率和产物吸收均有明显差异,Fe-N合金药物洗脱BRS在犬冠状动脉和膝下动脉中腐蚀最快,兔子髂动脉和腹主动脉次之,猪冠状动脉最慢,在人的冠状动脉及动脉导管(PatentDuctus Arteriosus, PDA)中的腐蚀速率介于犬和兔子之间。另外,腐蚀产物吸收速率还与吞噬细胞的多少有关,吞噬细胞越多,腐蚀产物吸收越快,Fe-N合金药物洗脱BRS在在猪冠状动脉、犬冠状动脉和兔子髂动脉腐蚀吸收时,组织中均有大量吞噬细胞,因此腐蚀产物吸收速率最快,且吸收彻底。而在兔子腹主动脉中,吞噬细胞数量最少,因此对Fe-N合金药物洗脱BRS腐蚀产物吸收速率最慢。
Fe-N合金药物洗脱BRS(IBS)在小型猪冠脉植入后180 d新生内膜增生程度与DES相似,且内皮化速度快,无组织炎性反应,生物相容性好。植入90 d后支架没有腐蚀,180 d随访时可见部分支架杆腐蚀,无全身毒性反应。在兔子腹主动脉模型中植入Fe-N合金药物洗脱BRS,并对支架中各种元素的降解吸收速度进行分析:1)植入后锌缓蚀层立即开始腐蚀并在3个月接近完全腐蚀,失重接近100%;2)西罗莫司在支架植入后6个月时达到80%的释放;3)PDLLA涂层在植入后18个月100%降解;4)Fe-N合金骨架在开始的2个月内保持完好无损,在植入后3个月出现了轻微的腐蚀降解,当锌完全腐蚀后,Fe-N合金基体经历了是相对快速的腐蚀阶段,到18个月时,腐蚀失重接近80%,最终在24个月乎完全腐蚀。在Fe-N合金药物洗脱BRS临床试验中,通过OCT分析人体冠脉的血管,6个月完全内皮化,无新生动脉粥样硬化斑块,6个月时支架杆吸收34%,1年52%,2年82%,3年接近100%吸收,早期较快,聚乳酸涂层完全降解后铁腐蚀趋缓。
2.3. Fe-N 合金BRS 磁共振成像兼容性
由于本征的铁磁性,铁基BRS的磁共振成像(Magnetic Resonance Imaging, MRI)的兼容性备受关注。MRI成像过程中可能会引入安全性的3个风险,即磁感应位移力,磁致扭矩以及磁感应射频热。此外,与成像序列相关的器械的MRI伪影虽然不会对病人造成直接伤害,但是其会影响医生的诊断,导致误诊风险。通常,若器械引入的安全性风险可以忽略不计,但其伪影导致的MRI图像不可用于诊断,则称此器械MRI安全的,但是MRI不兼容;若器械是MRI安全的,且在MRI成像中不会引入伪影,则此器械是MRI兼容的。Bian等分别在体外和体内评估了Fe-N合金药物洗脱BRS的MRI安全性和兼容性,包括支架在血管中移动、温升、图像伪影和可能的血管损伤。研究结果显示,尽管Fe-N合金药物洗脱BRS为铁磁性材料,但支架的铁质量非常小,最大规格的BRS(直径4 mm,长度38 mm)含铁量仅约3 mg,支架所受到的磁感应位移力约是质量的10倍,因此不会造成支架损伤血管,且MRI期间支架温升仅1.3 ℃,低于同规格不锈钢支架,对组织并无热影响,因此,Fe-N合金药物洗脱BRS与永久支架一样是MRI安全的。在3.0 T磁场下的伪影研究结果显示,支架刚植入时,MRI伪影比316L不锈钢支架小但比Co-Cr合金DES伪影大,1年后伪影尺寸显著减小,但仍比Co-Cr合金DES略大,这主要是腐蚀产物中具有铁磁性的Fe3O4导致的,腐蚀产物完全吸收后伪影消失,此时,Fe-N合金药物洗脱BRS是MRI兼容的,如图8(a) 所示。在考虑MR兼容性上,需要认识到以下两个事实:1)MR兼容性是材料磁性和用量共同作用的结果,相同规格的316L不锈钢支架的磁致热和MR伪影比IBS还大,是因为奥氏体316L不锈钢强度远低于Fe-N合金,需要更多材料来达到相同的支架支撑力;2)医疗器械中常用金属和合金材料都有MR伪影,即金属磁化率伪影。根据Oliver 等[90]的报道,即便是镁合金,其在3~7 T 磁场强度下也有伪影,见图8(b)

图 8 Fe-N(a)合金药物洗脱IBS 不同降解程度下MRI 伪影[88]及(b)镁合金及铁合金可吸收血流导向装置磁共振成像伪影
3. Fe-N 合金BRS 临床研究
目前,全球仅有深圳元心科技研发的Fe-N合金系列BRS在进行人体临床研究。该公司目前共有3个产品在进行临床实验,分别是可吸收儿童肺血管支架(IBS Angel)、可吸收药物洗脱冠状动脉支架(IBS)和可吸收药物洗脱外周支架(IBSTitan)。IBS Angel适用于需要支架治疗改善肺血流量疾病的患者,肺血管包括右室流出道、肺动脉干、肺动脉分支和动脉导管。IBS适用于改善由原发性冠状动脉缺血导致的冠心病患者。IBSTitan适用于改善需要支架治疗的患者腘下动脉缺血的患者。这3个产品均使用相同的Fe-N基体,相同的Zn缓蚀层和PDLLA涂层设计, 除IBS AngelPDLLA聚乳酸涂层中未携带西罗莫司药物外,其他2个产品PDLLA涂层中均携带抗平滑肌细胞增殖的西罗莫司。此外,因膝下动脉病变长,针对适应症的特殊性,IBS Titan的长度规格比其他2个产品更长(最长118 mm),但其他设计均相同。
IBS Angel已于2018年在马来西亚国家心血管研究院和Ministry of Health开展了一项前瞻性、非随机、非盲、单组研究,用以评估支架系统在儿童患者中的有效性和安全性。该研究共纳入35例受试者,其中32例接受动脉导管(Patent DuctusArteriosus, PDA)BRS植入,2例接受右室流出道(Right Ventricular Outflow Tract, RVOT)BRS植入,1例接受肺动脉(Pulmonary Artery, PA)BRS植入,最小的患者为一位3.1 kg新生早产儿。该临床试验中的手术成功率为100%,死亡率为8.57%,再介入率为11.43%。与支架植入以及BT分流术的文献汇总数据对比后,铁基BRS性能较为良好,不论是外科BT分流术,还是off-label use的冠脉永久支架植入术,铁基BRS结果均优于或与其结果相当,且具有可吸收的特性,无永久留在体内的金属残留物,可有效避免远期风险。2021年,由广东省人民医院张智伟教授领衔的一项前瞻性、非随机、非盲、单组、多中心的临床研究在我国进行,适应症为先天性心脏病后的原发和继发肺动脉狭窄,支架设计为Fe-N合金裸金属BRS, 支架直径从2.25~16.0 mm。目前已有部分短期3个月的随访结果报告,报告显示11例患者均成功植入Fe-N合金BRS,没有与器械或操作相关的主要心血管不良事件,肺动脉分支血流灌注立即改善,随访期间无ST、血管栓塞、支架移位及心力衰竭事件,更多的病例还在临床入组中。此外,IBS Angel儿童肺动脉支架已通过美国FDA同情使用(Compassionate Use)途径获批植入。
IBS于2018年由北京阜外医院高润霖院士领衔进行首次人体临床试验,总计入选45例患者,每例患者均为1个原发病灶。纳入的患者被随机分配到2个随访队列,队列1(n=30)于6个月和24个月,队列2 (n=15)于12个月和36个月进行血管造影和血管内超声(Intravascular Ultrasound, IVUS)和OCT影像学随访,临床随访时间为1个月、6个月和12个月,而后每年随访1次,直至5 y。主要终点是6个月时TLF和血管造影LLL。研究结果显示,6个月和3年的TLF率分别为2.2%和6.7%,所有病例均因有临床指征的TVR所致。随访3年时,无死亡、心肌梗死及ST发生。支架段6个月时LLL为0.33mm±0.27 mm,3年时0.37 mm±0.57 mm,OCT随访血管管腔平均面积从7.22 mm2(6个月)稳定扩大到了8.02 mm2(3年),与报道的其他永久DES、聚乳酸BRS和镁合金BRS,随随访时间增加,血管管腔面积持续减小显著不同,如图 9 所示。OCT还确认术后6个月和1 y时支架被覆盖的比例分别为99.8%和100%,3年支架吸收率为95.4%。同样是高润霖院士领衔的IBS-II前瞻性、多中心、随机对照临床研究已于2022年完成259对518例的患者入组,目前已完成1年临床随访,安全性和有效性不劣于对照组所使用的DES。IBS-III前瞻性、多中心、单组目标值也于2023年完成802例患者入组。IBS临床试验中不强制要求PSP操作和延长双抗时间,手术的成功率均为100%,显示出了IBS系列BRS优异的临床操控性。
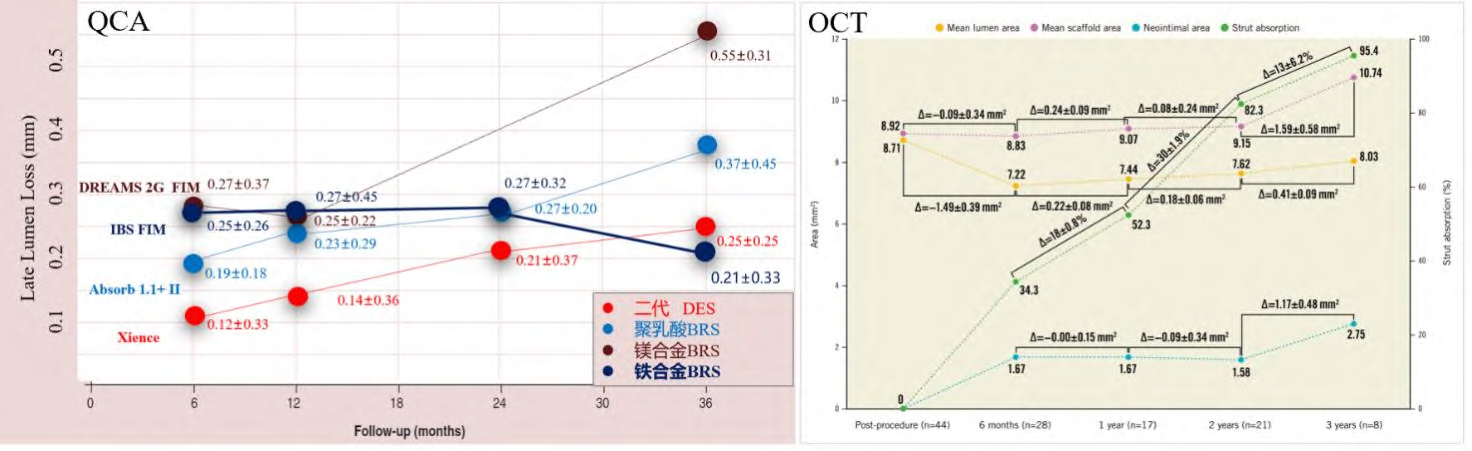
图 9 不同类型的BRS和DES QCA分析节段内(in-segment)LLL及IBS连续3年OCT随访分析
IBS Titan于2020年由北京301医院的郭伟教授领衔进行了首次人体临床试验,完成12例入组,Sun等[95]报告了1例6个月和13个月随访结果,血管造影和血管内超声(Intra Vascular Ultra Sound.IVUS )检查证实IBS Titan支架植入后血管通畅。2021年IBS Titan-II的前瞻性、多中心、随机对照临床研究也在进行中,计划总计120例患者,即60对支架与裸球囊进行随机对照实试验,主要终点是180天的靶病变免于造影显示的闭塞、临床驱动的靶病变血运重建(Clinically Driven Target LesionRevascularization, CD-TLR)以及踝关节以上的主要截肢率优效于裸球囊,目前入组还在进行中。另一项临床研究由Fanelli 教授担任主要研究者,已于2023年7月在欧洲意大利佛罗伦萨市AziendaOspedaliero Universitaria Careggi中心完成首例人体植入,该临床试验在意大利、德国、奥地利、荷兰、比利时等多个欧洲国家,共计15家医院开展,计划入组100例患者。截至目前,IBS Titan已获得美国FDA同情使用批准并植入。
4. 面临的挑战与展望
根据已报道的Fe-N合金BRS动物体内和有限的人体内植入研究结果显示,Fe-N合金药物洗脱BRS在血管内降解比较接近BRS的降解需求。但是,目前对血管修复所需的支撑力要求和时间还需更深一步研究,将Fe-N合金BRS植入人体的心脏血管中尚属首次,缺乏大量和长期的临床数据去发现可能存在的问题和风险。此外,Fe-N合金BRS支架杆壁厚通常在50 μm左右,材料中5 μm左右的夹杂均可能导致支架扩张时断裂,产生不可接受的风险,如何提高纯铁的纯净度和最终产品的无损夹杂检测也是目前面临的一大技术挑战。Fe-N合金BRS虽然获得了儿童肺血管适应症的CE认证,但作为新产品和新技术,后期临床使用中一定存在不足之处,尚有许多可以提升的空间。通过渗N技术在纯铁中仅渗入0.05wt.%的N元素,在不添加其他有害元素的情况下,将纯铁材料的综合力学性能提升至Co-Cr相似水平,使得Fe-N合金药物洗脱BRS壁厚和综合力学性能媲美当今主流DES,初步人体临床试验表明,Fe-N合金药物洗脱BRS在人体冠脉中6个月完全内皮化,2~3 y基本完全吸收,TLF与普通Co-Cr合金DES相当,支架降解后管腔基本维持不变或扩大。但是,由于人体环境复杂,Fe-N合金药物洗脱BRS首次应用于人体植入,需大量随机和真实世界的长期临床循证医学数据支持吸收前的安全性和有效性不劣于当今的DES,且远期TLF和LST发生率低于目前的永久支架,则有望成为主流血管支架,开启Fe-N合金BRS的时代。
